去年,我國新藥注冊臨床試驗數量再創歷史新高。其中,細胞與基因治療藥物、“跨界藥王”司美格魯肽以及兒童新藥研發的市場熱度高漲。
19日,國家藥監局藥審中心(CDE)發布《中國新藥注冊臨床試驗現狀年度報告(2024年)》(下稱“報告”)。CDE表示,該報告旨在展示中國新藥注冊臨床試驗現狀,進一步提升臨床試驗的透明度,為新藥研發與審評審批提供科學參考。報告分析基于藥物臨床試驗登記與信息公示平臺的臨床試驗數據。
第一財經梳理近五年CDE年度報告發現,2024年,我國新藥注冊臨床試驗數量為近五年新高。繼2023年“藥物臨床試驗登記與信息公示平臺登記臨床試驗總量首次突破4000項”后,2024年這一數量逼近5000項(4900項),較上一年增長了13.9%。
與此同時,在過去的一年,(新藥臨床試驗)申請人完成首次試驗登記用時進一步縮短,臨床試驗啟動效率進一步提高。根據報告,超六成試驗在6個月內簽署首例知情同意書,其中生物制品在6個月內簽署首例知情同意書的比例達到70.2%。
“2024年臨床試驗登記總量保持增長,我國臨床研發呈現積極態勢。”這是CDE在報告中給出的結論。
新藥臨床試驗的開展仍呈現地域集中的趨勢。根據報告,2024年臨床試驗參加單位超2000次的有6個地區,較去年增加3個地區,包括廣東省、北京市、江蘇省、河南省、浙江省和山東省。廣東省為參加單位次數最多的地區,共2892次。
分領域看,隨著亞健康群體、糖尿病和肥胖等人群增多,國內代謝類新藥研發的市場競爭加速,這一趨勢也與國際趨同。根據報告,2024 年化學藥品臨床試驗數量前10位品種共登記86項試驗,占化學藥品總體6.1%(86/1413)。以司美格魯肽注射液開展的試驗數量最多,為 14 項。從適應證領域分析,前10位品種中內分泌系統藥物試驗共39項,涉及5個品種。
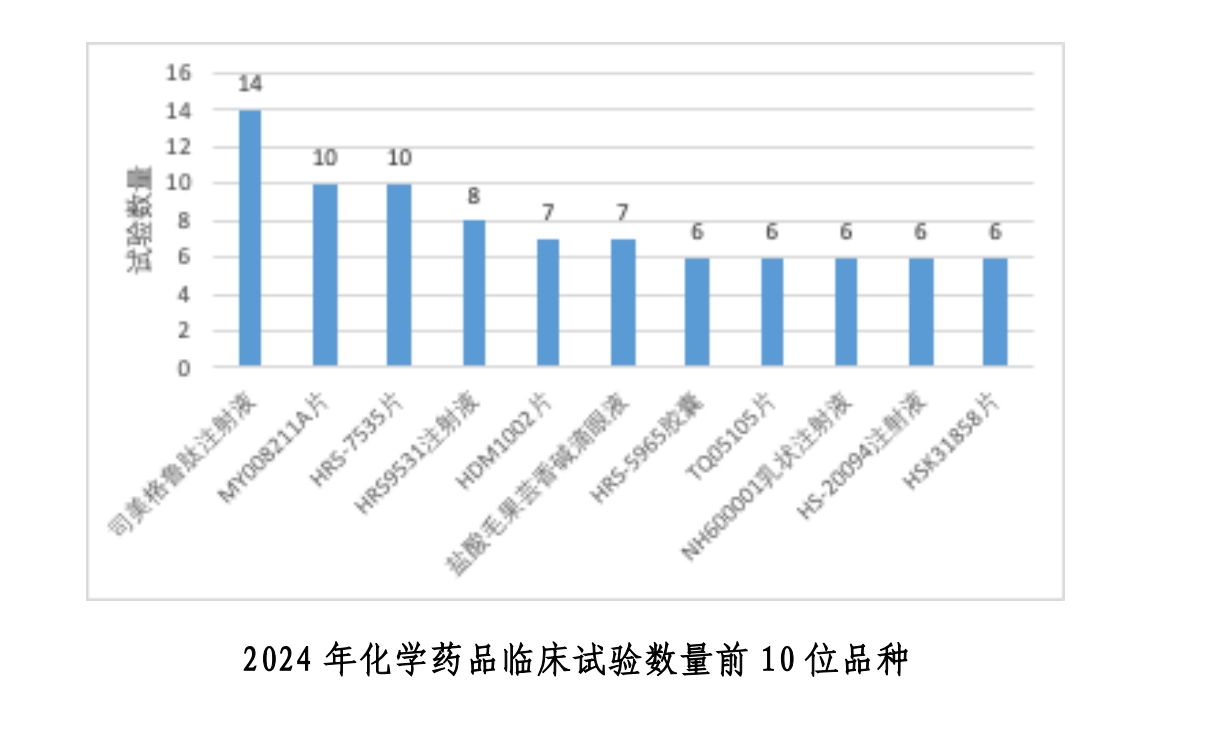
《中國新藥注冊臨床試驗現狀年度報告(2024年)》
生物制品開展臨床試驗數量前10位品種中,司美格魯肽注射液同樣開展臨床試驗數量最多,有15項。也就是說,去年我國司美格魯肽臨床試驗注冊數量已達29項。
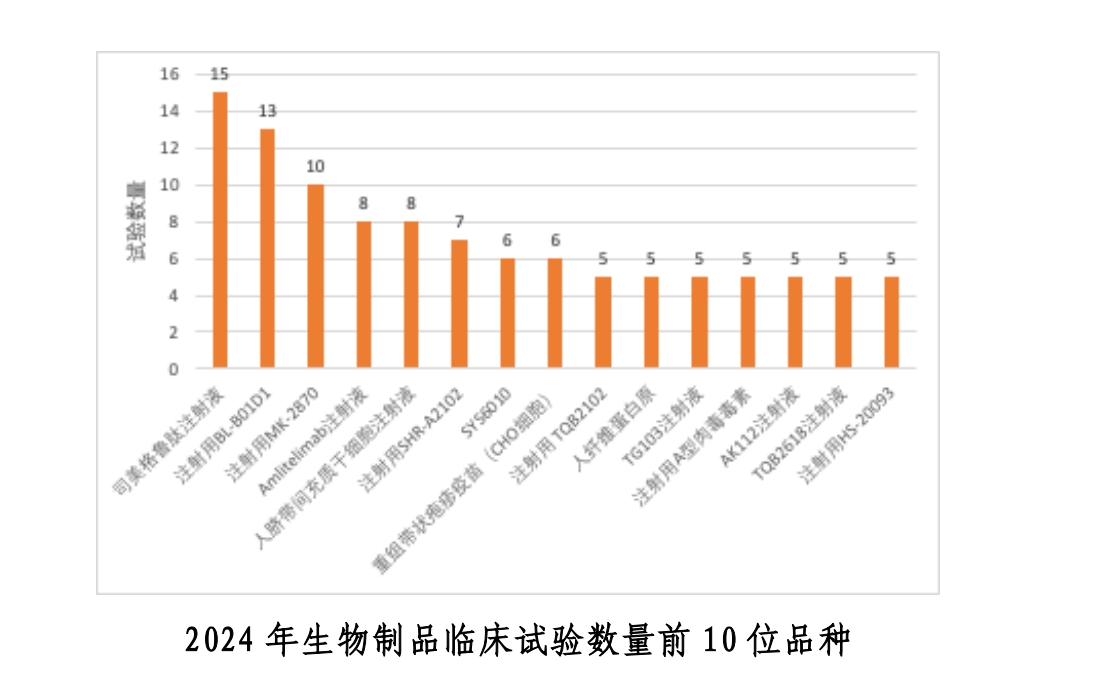
《中國新藥注冊臨床試驗現狀年度報告(2024年)》
從適應證分析,根據報告,去年,1類創新藥臨床試驗以抗腫瘤藥物為主,占1類創新藥總體的39.0%(677/1735)。其中在生物制品的這類新藥臨床試驗中,抗腫瘤藥物更是占據的“半壁江山”,達到占比50.1%。此外,從趨勢來看,1類抗腫瘤創新藥Ⅲ期臨床試驗保持小幅增長,意味著多款抗腫瘤創新藥距離上市更進一步。
近年來,為回應兒童用藥短缺問題,國家藥監局成立兒童用藥專項小組,在審評系統中設立“兒童用藥”特殊標識,優化審評資源配置,并發布了多項兒童用藥專項指導原則,為研發和審評提供了重要技術支撐。
在政策和市場的合力推動下,報告顯示,2024年,針對兒童人群開展的臨床試驗數量和在新藥臨床試驗中的占比均保持增長,相關適應證主要為呼吸系統疾病及抗過敏和預防性疫苗。
另一類填補臨床缺口的藥物為罕見病用藥。根據報告,從臨床試驗數量上看,罕見疾病藥物臨床試驗登記數量呈逐年遞增趨勢。適應證領域均保持相對穩定,以血液系統疾病、神經系統疾病和抗腫瘤藥物為主。2024年,血液系統疾病藥物臨床試驗數量最多,占年度罕見疾病臨床試驗總量的近三成。
此外,報告還發現,2024年,醫學影像學和放射性藥物臨床試驗數量保持小幅增加。與此同時,細胞和基因治療類(CGTs)產品臨床試驗數量較 2023 年增長明顯。
近期,CDE發布《先進治療藥品的范圍、歸類和釋義(征求意見稿)》,擬將CAR-T、腫瘤疫苗等CGTs藥物納入 “先進治療藥物”范疇。而在更早之前,商務部、國家衛生健康委、國家藥監局于去年9月聯合發布《關于在醫療領域開展擴大開放試點工作的通知》,允許外商投資企業在北京、上海、廣東、海南四地自由貿易試驗區/自由貿易港有條件地從事人體干細胞、基因診斷與治療技術開發和技術應用,意味著中國在CGT領域的對外開放邁出重要一步。
曾有多名接受第一財經采訪的業界人士均認為,CGTs是我國在創新藥前沿領域實現全球領跑的關鍵賽道,近年來,我國在該領域監管政策趨向包容、開放、科學與規范。在此背景下,CGTs藥物研發進程有望提速,為腫瘤、遺傳和罕見疾病等領域患者治療提供新的可能性。但高昂的研發成本、治療的風險以及患者可及性和可負擔性等桎梏行業發展難題,仍待進一步解決。
幫企客致力于為您提供最新最全的財經資訊,想了解更多行業動態,歡迎關注本站。鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息之目的,如作者信息標記有誤,請第一時間聯系我們修改或刪除,多謝。



